|
 |
|
TEMA
 |
|
|
Tema 22
Reproducción Asexual
o Multiplicación vegetativa
La multiplicación o propagación
vegetativa es la producción de una planta a partir de
una célula, un tejido, un órgano o parte de una planta
madre.
Distintas partes del cuerpo de una planta,
bajo determinadas condiciones de crecimiento (luz,
temperatura, humedad, nutrientes, sanidad, etc.) pueden dar
origen a un individuo completo. Esto se debe a que muchas
células de los tejidos diferenciados (maduros) de la planta,
conservan la TOTIPOTENCIALIDAD, con esta característica una
célula ya adulta puede desdiferenciarse
(retomar la
actividad meristemática) y multiplicarse dando origen a los
órganos vegetativos (raíz, tallo y hojas). |
Reproducción sexual (para recordar este
concepto antes de empezar):
En una célula del óvulo (célula madre de la megáspora)
se produce la meiosis que concluye con la formación de cuatro megásporas
haploides. En la mayoría de las angiospermas sólo una de las megásporas
es funcional (las demás degeneran) y se divide por mitosis para formar
un saco embrionario octonucleado integrado por una ovocélula, dos
sinérgidas, dos núcleos polares y tres antípodas. La ovocélula se
fecunda con una gameta masculina dando el cigoto que originará el
embrión diploide y la segunda gameta masculina fecundará la célula del
medio dando origen a una célula triploide que se dividirá mitóticamente
para originar el endosperma.
|
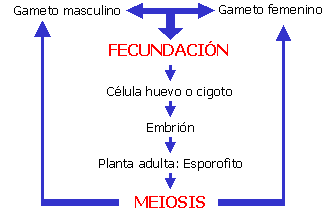 |
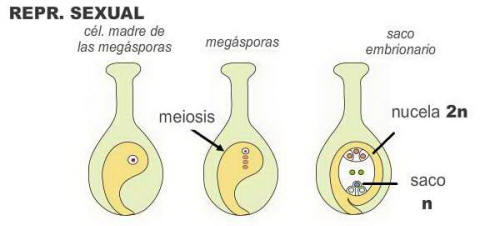
Imagen modificada de Hartmann and
Kester’s Plant Propagation,
Principles and Practices 8th ed.
|
Comparando los procesos:
Multiplicación vegetativa
Cuestión de terminología: hay varios términos que son
usados casi indistintamente para nombrar a la multiplicación
vegetativa. Por ejemplo: Clonación // o // Reproducción asexual // o
// Reproducción clonal // o // Regeneración vegetativa.
La propagación vegetativa se conoce desde el inicio de
la Agricultura con la domesticación de muchas especies de plantas que se
cultivan hasta nuestros días. Existe una gran variedad de métodos, desde
los procedimientos más sencillos (ej. estacas) hasta los
tecnológicamente más complejos (ej. cultivo in-vitro de tejidos) según
los requerimientos de cada caso.
Ventajas de la reproducción vegetativa
La propagación vegetativa ha adquirido gran importancia,
comprende un variado conjunto de técnicas que permiten multiplicación de
numerosas especies de interés agronómico. Algunos de sus objetivos son:
- Valorar genéticamente material vegetal, incluyendo estudios de
interacción genotipo ambiente.
- Preservar genotipos y complejos genéticos en bancos clonales.
- Acortar los ciclos reproductivos para acelerar los procesos de
cruzamiento y prueba.
- Conservar genotipos superiores que determinan características
genéticas favorables (resistencia a plagas y/o enfermedades,
crecimiento, , tolerancia a condiciones
extremas de humedad).
Tipos de Multiplicación vegetativa
Los métodos de propagación pueden ser clasificados como
naturales, según si se trata de estructuras
propias de las plantas que le permiten reproducirse asexualmente
(bulbos, tubérculos, rizomas, estolones, hijuelos, apomixis) o artificiales si son
producidas por el hombre (estaca, esqueje, injerto, acodo y cultivo in vitro).
Bulbos:
Son órganos subterráneos de
almacenamiento de nutrientes. Morfológicamente es una adaptación de
las hojas al almacenamiento de sustancias de reserva (engrosamiento
de la vaina con transformación en catáfilas), con
modificaciones en el tallo (platillo o disco) y raíces adventicias (ver
detalle en el tema adaptaciones)
Pueden tener yemas laterales, las que durante
el período de crecimiento dan origen a nuevos bulbos, denominados
bulbillos.
Los bulbos se clasifican en tunicados, en los que sus bases
están rodeadas por capas superpuestas cuando el bulbo está
totalmente rodeado por las bases persistentes de las hojas (ej.
cebolla, ajo, tulipán, narciso) y escamosos, en los que
dichas bases están imbricadas, son más carnosas y no tienen túnica
de protección (ej. lirio, azucena). Ambas clases producen bulbillos
que sirven para reproducir las plantas, una vez que han alcanzado el
tamaño suficiente.
AJO, Allium sativum:
El cultivo se establece vía asexual por medio de la plantación de
los bulbos del ajo o “dientes” directamente en la tierra con el borde
agudo hacia arriba. Recuerde la estructura de un diente: el extremo
inferior, más ensanchado, contiene al tallo (braquiblasto, disco o
platillo) que desarrollará en su base las raíces adventicias y en la
parte superior lleva la yema apical, rodeada por las bases foliares de
dos hojas concéntricas. La externa es delgada y de protección y la
interna es reservante. Las sustancias allí almacenadas servirán de
alimento para que la nueva planta crezca hasta que desarrolle las
primeras hojas verdes que le permitan fotosintetizar.
 |
 |
 |
|
Corte transversal de una
cabeza de ajo con dientes.
http://www.espores.org |
Cultivo de los dientes |
Cabeza de ajo brotada |
CEBOLLÍN, Nothoscordum inodorum (y otras
especies del género) son malezas de la familia de las Liliáceas, también
conocidas como ajo macho, lágrima de la Virgen, cebolla del diablo. Son
malezas de huertos, viveros, chacras, jardines y cultivos del NE de
Argentina. Se propagan por semillas y por bulbillos (comúnmente
diseminados por los instrumentos de labranza). Hierba bulbífera,
presenta un bulbo de hasta 2 cm de diámetro con numerosos bulbillos
circundantes. Habita en suelos húmedos, arenosos, arenoso-humíferos y
son muy difíciles de erradicar.
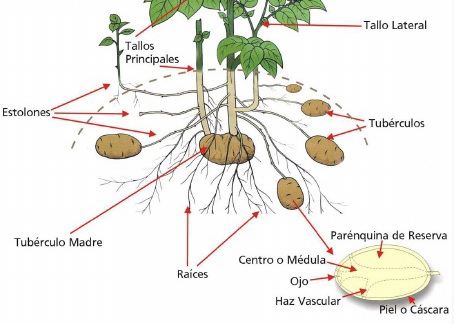
Tubérculos caulinares:
Son tallos modificados y
engrosados donde se acumulan sustancias de reserva, comúnmente
almidón. Lea la
estructura del tubérculo en el tema
adaptaciones. La
reproducción de este tipo de plantas se realiza utilizando en la
plantación el mismo tubérculo, que posee yemas en la superficie capaces
de rebrotar y originar nuevos ramas y raíces adventicias.
PAPA, Solanum tuberosum
spp. tuberosum,
La planta de papa,
puede reproducirse por semillas (vía sexual) y también por
tubérculos o “papa semilla” (vía asexual). En Argentina para establecer el cultivo,
para la producción de papa consumo, se utilizan “papa
semillas”.
Estas pueden ser:
 |
“papa semillas enteras", denominadas vulgarmente “semillones”
que son papas pequeñas (entre 30 - 90 g) o del tamaño de
un huevo, |
 |
o "papa semilla cortada". Esta práctica
no es recomendable efectuarla debido al riesgo de cortar
yemas, que provoca menor número de plantas por unidad de
superficie y riesgo de propagar enfermedades,
deshidratación e infección. |
https://redepapa.org
|
 |
Rizomas:
Son tallos subterráneos con
varias yemas que crecen de forma horizontal emitiendo raíces y
brotes herbáceos de sus nudos. Carecen de hojas pero tienen
catáfilas a veces en forma de escamas membranosas (ver
detalle en el tema adaptaciones). Los
rizomas tienen un crecimiento indefinido. Pueden cubrir grandes
extensiones de terreno debido a que cada año producen nuevos brotes
a medida que las primeras ramas van muriendo.
Para cultivar la planta, los rizomas se pueden dividir en trozos que
contengan por lo menos una yema y plantarlos. Las plantas con
rizomas son perennes, pierden sus partes aéreas en climas fríos,
conservando tan solo el órgano subterráneo que almacena las
sustancias de reserva para la temporada siguiente.
CULTIVOS: el jenjibre, Zingiber officinalis,
es una monocotiledónea de origen asiático que se cultiva en los trópicos
casi exclusivamente por vía asexual ya que muy raramente produce
semillas. Los rizomas monopodiales pueden medir hasta 50 cm y
frecuentemente son chatos y divididos como los dedos de una mano. El
parénquima reservante es rico en almidón y oleorresinas que le dan el
sabor picante. Contienen además cantidades apreciables de hierro,
fósforo y ácido ascórbico.
 |
 |
| Zingiber officinale,
jengibre |
Jengibre formando vástagos
aéreos |
MALEZAS: este es uno de los principales
mecanismos de propagación. El principal ejemplo es el Sorghum
halepense o sorgo de alepo, que fue declarada Plaga de la
Agricultura Nacional en 1930 por su capacidad de multiplicarse a partir
de sus rizomas. Deben extremarse las medidas preventivas empleando, para
la siembra de cualquier cultivo, semilla fiscalizada libre de semillas
de esta maleza y extremando la limpieza de la maquinaria agrícola para
controlar la dispersión de los rizomas.
Cuando la invasión se presenta en forma de “manchones” se evitará
pasar la rastra de dientes que fracciona los rizomas y los difunde en
mayor extensión… (Marzocca, 1993), recuerde que cada fragmento de
rizoma que contenga al menos una yema será capaz de originar una nueva
planta.
|
 |
 |
|
Sorgo de alepo: detalle de sus rizomas |
Estolones:
Son brotes o ramas laterales más o menos
delgados que nacen de la base del tallo, que crecen horizontalmente
con respecto al nivel del suelo o subterráneo. Tienen entrenudos
largos que generan raíces adventicias. La separación de estos
segmentos enraizados da lugar a plantas hijas.
FRUTILLA (Fragaria x ananassa):
este cultivo se establece mediante la plantación
de plantines que se obtienen a partir de una planta madre que emite
estolones que, una vez enraizados, son separados de la planta original.
Los plantines obtenidos por reproducción vegetativa, clonación, son
genéticamente idénticos a la planta madre. La frutilla es una planta
herbácea con raíces fasciculadas. El tallo es un braquiblasto que
vulgarmente lo llaman “corona”. Las hojas insertas en él llevan una yema
axilar que puede ser reproductiva y originar flores y frutos, o si son
vegetativas pueden resolverse en nuevos braquiblastos laterales o en
ramas delgadas radicantes: los estolones. Usualmente los
estolones tienen dos entrenudos muy largos que anteceden a un
braquiblasto que será la futura “corona” de la nueva planta. El el
extremo del estolón la primera hoja es rudimentaria.
Hijuelos:
Son un tipo característico de brote
lateral o rama que se desarrolla sobre la base del tallo principal
de ciertas plantas. Este término se aplica generalmente al tallo
engrosado, acortado y con aspecto de roseta. El término hijuelo o
macollo, como algunas veces se lo denomina, se aplica al cultivo de
plátanos, ananá o piña, palma datilera, entre otros. La formación de hijuelos o macollos es muy importante en cultivos de
Monocotiledóneas tales como los cereales de grano y forraje: trigo,
cebada, centeno y avena.
ANANÁ (Ananas comosus) el eje sigue creciendo para
dar origen a una nueva planta, este proceso se conoce como
proliferación. En ananá la multiplicación vía agámica es la más
frecuente y si bien todos los tipos de hijuelos que presenta esta
especie son potencialmente capaces de generar una planta, los que se
eligen y mayormente se utilizan para iniciar un plantación comercial,
son aquellos provenientes de la base del tallo.
|
BROMELIACEAE Ananá |
|

Detalle de la planta con
infrutescencia e hijuelo en la base
© P.Alayón |
 |
|
Hijuelos para
multiplicación. ©
P.Alayón |
|

Hijuelos en macetas. © P.Alayón |
BANANO, Musa ×
paradisiaca: las plantaciones comerciales se
pueden iniciar de hijuelos o de trozos de cormo que tengan yemas. En el caso de
utilizar hijuelos es necesario diferenciar aquellos denominados
“haraganes” o “de agua” de aquellos llamados “espadines”. La forma de
los primeros es cilíndrica mientas que los segundos son cónicos. Los más
convenientes son los “espadines” ya que entran primero en producción en
comparación con los “haraganes”.
 |
 |
|
Banano con Hijuelos "haraganes".
© P.Alayón |
Hijuelos “espadines”.
© P.Alayón |
Estacas o esquejes (Fitómeros):
La propagación por estacas es una técnica de
multiplicación vegetal en la que se utilizan trozos de tallos, los que
colocados en condiciones ambientales adecuadas son capaces de generar
nuevas plantas idénticas a la planta madre. Estas porciones son fitómeros: es la menor porción formada por un nudo con la
yema y una porción de los entrenudos superior e inferior que permite la
multiplicación. Plantadas bajo condiciones
ambientales favorables se induce a formar raíces, y luego
desarrolla el vástago produciendo así una nueva planta independiente. A menudo se usa esqueje para referirse a ramas
jóvenes o de menor consistencia y estaca para tallos lignificados.
La capacidad de una estaca para formar un sistema radical o caulinar
adventicio depende de factores endógenos, es decir propios del material,
y de factores exógenos (ambiente)
Este es el método más importante para propagar arbustos
ornamentales y varios cultivos arbustivos y leñosos. Un ejemplo de
propagación de estacas leñosas de uno o dos años son las higueras (Ficus
carica), el kiri (Paulownia tomentosa) o de estacas
semileñosas son los olivos (Olea europea) y la
vid (Vitis
sp.).
 |
 |
 |
| Estacas de Kiri
© C.Luna |
Estacas de higo ya
multiplicadas © P.Alayón |
Estacas de Olivo
enraizadas y con hojas ©
J.Caballero |
En el caso del té (Camellia sinensis) y la yerba (Ilex paraguariensis),
la plantación puede tener dos orígenes: semilla botánica o
material vegetativo para obtener clones, denominado estaqueo. En nuestro país las
plantaciones más antiguas de té se establecieron mediante plantines de
semilla de fenotipos chinos, assámicos o sus correspondientes híbridos,
por lo cual existe una gran variabilidad genética en los cultivos. En
ambos cultivos hace
algunos años se están comenzando a utilizar plantaciones clonales de
rendimiento superior. La implantación de clones selectos permiten que
los cultivos presenten mayor homogeneidad, rendimiento y calidad. La
propagación vegetativa del té se realiza por medio de la plantación de
estacas semileñosas uninodales (5 a 8 cm de longitud y 5 a 7 mm de diámetro) con
una hoja y que sean de la brotación del año para que posea
características de juvenilidad y así facilitar su enraizamiento
adventicio. En la yerba la estaca es multinodal, la hoja se corta media lámina para evitar el
exceso de transpiración, sin la hoja presente no se produce el enraizamiento.
Una forma de distinguir un plantín clonal (de estaca) de otro de semilla
(sexual), es la presencia de un sistema radical sin raíz pivotante en el
primer caso (tienen "forma de estrella").
| Propagación
comercial en
invernadero de leñosas |
 |
 |
%20Ricardo%20Medina.jpg) |
|
Estaca de Eucalyptus
grandis mostrando el sistema radical típico de una
plantín clonal
© C.Luna |
Estacas de yerba (Ilex
paraguariensis): se deja media lámina de una hoja.
© C.Luna |
Estacas semileñosas de té (Camellia
sinensis. © R.Medina |
Al colocar un fitómero o estaca a enraizar
recuerden que se está colocando un tallo, a veces con
crecimiento secundario. Para enraizar se necesitan células
totipotenciales -con núcleo- que se desdiferencien y puedan
regenerar un meristema apical radical que forme una raíz
completa.
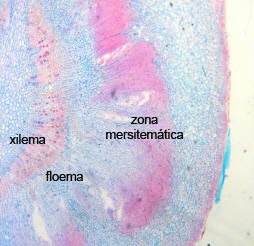
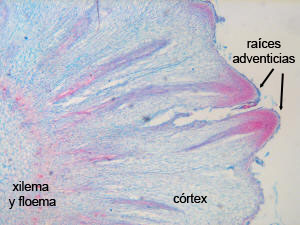
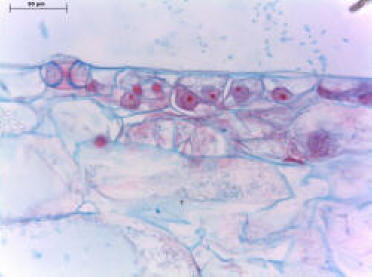
En las dos fotos de cortes histológicos se ve la
ONTOGENIA de la formación de raíces adventicias de la yerba: son
cortes transversales de una estaca de yerba durante este
proceso. En la 1º foto se observa el xilema y el floema
secundario, y a partir de células del parénquima floemático se
forma una zona meristemática precursora de las raíces. En la 2º
foto ya se aprecian dos primordios radiculares que debieron
atravesar el córtex y están emergiendo de la estaca.
 |
 |
 |
|
Estacas multinodales de
Yerba (Ilex paraguariensis) mostrando raíces adventicias
© J.Tarragó |
1º: corte transversal
de estaca de yerba en inicio de diferenciación de raíces
© J.Tarragó |
2º: corte transversal
de estaca de yerba con dos raíces emergiendo del córtex.
© J.Tarragó |
PINO: (y coníferas en general) se considera
semilla forestal al "cutting" que es la porción terminal de
un macroblasto, incluyendo la yema apical (cutting es la
denominación usada en este cultivo en Argentina). Las plantas
madre (clones selectos) dadores de cuttings se pueden mantener a
campo o en viveros.La cosecha se realiza manualmente o
mecanizada.
| |
 |
 |
 |
|
Plantas madre o setos
clonales © C.Luna |
Detalle del cutting para
enraizar |
Pino: cutting enraizando y
arriba el mismo 4 meses
después. © C.Luna |
MANDIOCA (Manihot esculenta).
Los tallos de la mandioca son particularmente importantes pues se
utilizan para la multiplicación vegetativa o asexual de la especie.
Porciones lignificadas del tallo, llamadas estacas, sirven como
material de plantación para la producción comercial del cultivo. Para
garantizar el éxito de la plantación se recomienda que las estacas se
obtengan de ramas maduras, aquellas cuya proporción de leño sea igual o
superior a la de la médula interna. En el leño se almacenan las
sustancias de reserva que sustentarán inicialmente la brotación de las
yemas laterales y el enraizamiento adventicio.
 |
 |
 |
|
Estaca con raíces
adventicias © A.Burgos |
 |
|
Cultivo
© A.Burgos |
Estaca con vástago joven
© A.Burgos |
Estaca con vástago y nuevos
tubérculos |
Este proceso puede realizarse también por cultivo in vitro de tejidos
(ver más adelante...):
| Mandioca: Cultivo in vitro |
 |
 |
|
Tuberización in vitro.
© R.Medina |
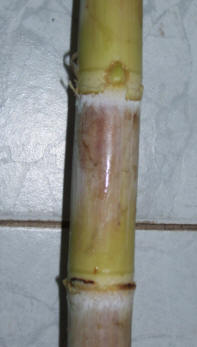
CAÑA DE AZUCAR (Saccharum officinarum)
La caña de azúcar se propaga asexualmente mediante la brotación de las
yemas axilares del tallo denominado en su conjunto “caña semilla” (trozo
de caña con al menos una yema, conocido como fitómero). A partir
de cada yema, se origina un brote guía o tallo primario, de las yemas
axilares de estos se forman tallos secundarios y de estos a su vez, los
tallos terciarios; conformando en su conjunto una cepa o macollo.
El enraizamiento inicial se produce a partir de la emergencia de las
raíces preformadas en la banda radical del fitómero, estas se reemplazan
luego por las raíces que se diferencian a partir del tallo primario.
 |
 |
| Cultivo de caña de azúcar |
Fitómero / estaca con
yema © R.Medina |
Acodo:
Es un método de propagación en el cual se provoca la
formación de raíces adventicias a un tallo que está todavía unido a la
planta madre. Luego, el tallo enraizado, acodado, se separa para
convertirlo en una nueva planta que crece sobre sus propias raíces. La
rama acodada sigue recibiendo agua y minerales debido a que no se corta
el tallo y el xilema permanece intacto. La formación de raíces en los
acodos depende de la provisión continua de humedad, buena aireación y
temperaturas moderadas en la zona de enraizamiento.
Se utiliza en ornamentales y en cultivos como la vid,
donde se denomina Mugrón, es un sarmiento o rama larga que,
sin cortarlo de la cepa, se entierra parcialmente en el
lugar próximo a la misma en el que hay una falta, doblándolo
de manera que quede la punta con un par de yemas al aire,
con el fin de que arraigue y dé origen a una nueva cepa. Una
vez que ya tiene raíces el sarmiento enterrado, se puede
"destetar" o cortar. |
 |
| Vid (Vitis sp.)
©http://blogs.larioja.com/ |
Propagación por injertos:
Son segmentos de plantas se adhieren a otra
receptiva más resistente o de mejores características (ej. cítricos,
frutales de pepita, cacao, rosales). El injerto es un método de
multiplicación que consiste en unir yemas de una determinada variedad o
cultivar sobre una estaca de otra variedad, cultivar, u otra especie (de
la misma familia botánica), con tolerancia normalmente a problemas de
suelo porciones de plantas de manera que formen un solo individuo. En un
árbol injertado se distinguen por tanto una parte situada por debajo del
punto de injerto, denominada hipobionte, portainjerto ó patrón, provista
generalmente de raíces y una parte superior, llamada epibionte, injerto
ó púa, destinada a formar la copa.
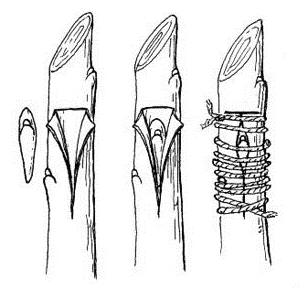
Formación de la unión del injerto, la secuencia de los
pasos en la cicatrización es la siguiente:
1. El tejido recién cortado de la púa, capaz de actividad meristemática,
es puesto en contacto íntimo y fijo con el tejido del patrón también
recién cortado en condiciones similares, de tal modo que las regiones
cambiales de ambas partes estén en contacto estrecho. Las condiciones de
temperatura y humedad deben ser tales que estimulen la actividad de las
células recién expuestas y de aquellas que las circundan.
2. En la región cambial tanto del patrón como del injerto, las capas
exteriores de células expuestas producen células de parénquima que
pronto se entremezclan y enlazan; al resultado de esa actividad se llama
“tejido del callo”.
3. Algunas de las células del callo recién formado que se encuentran en
la misma línea con la capa intacta de cámbium del patrón y del injerto
se diferencian hasta formar nuevas células cambiales.
4. Esas nuevas células de cámbium producen tejido vascular nuevo (xilema
hacia el interior y floema hacia el exterior) estableciendo así conexión
vascular entre patrón e injerto, requisito indispensable para que la
unión del injerto tenga éxito.
 |
 |
 |
Fases del injerto
http://articles.extension.org |
Injerto de cítricos.
Imagen de ©http://aggie-horticulture.tamu.edu/citrus |
Solanum sisymbriifolium
(tutiá) como pie de injerto en tomate. |
Las plantas cítricas son propagadas en forma asexual a
través de injertos y no a través de semillas, ya se trate de
explotaciones comerciales o con otros fines. La variedad de interés es
injertada sobre un pie o portainjerto. En consecuencia, la planta estará
constituida por dos partes: la copa y el pie. Por lo general, la especie
injertada es distinta de la del portainjerto, el cual es seleccionado en
función de diversos factores ecológicos como ser suelo, clima y
enfermedades. En la zona citrícola del norte argentino las especies
usadas como portainjertos son:
Lima de Rangpur (Citrus limoni) // Limón rugoso (Citrus
jambhiri) // Trifolio (Poncirus trifoliata) // Mandarino
Cleopatra (Citrus reshni) // Citranges que son híbridos entre
Citrus sinensis x Poncirus trifoliata.
Los injertos pueden transmitir enfermedades como virus,
bacterias o micoplasmas, por lo que se avanzó hacia la técnica de
MICROINJERTOS IN VITRO. El problema fue que no se disponen de
plantas sanas, por lo que la solución fue usar los meristemas.
Recordando la organización de los meristemas caulinares (ver
tema), son zonas en
diferenciación, con elevada actividad metabólica y aún no están
completamente formados los tejidos vasculares, por estas razones son
partes de una planta infectada que está libre del virus y se puede
reproducir in vitro.
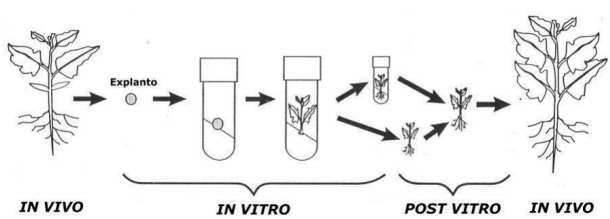
Esquema modificado a partir de Lindsey y Jones, 1989,
en Plant Biotechnology in Agriculture
Micropropagación o Cultivo in-vitro:
En esta técnica se utilizan células o pequeñas partes de
tejidos u órganos denominados EXPLANTOS, los mismos son
cultivados en condiciones controladas de laboratorio. La técnica se basa
en el hecho de que los tejidos vivos de las plantas conservan la
capacidad de dar origen a un organismo completo: TOTIPOTENCIALIDAD.
Las células que conservan mejor esta potencialidad son las que están
menos diferenciadas hacia una función específica, ya sea meristemáticas
(ej. meristemas apical de tallo o raíz, cambium) o células adultas que
consevan su núcleo (diversos tipos de parénquimas, como el de los
segmentos nodales, el parénquima de las hojas, embriones y algunas
partes florales). Gracias a la totipotencialidad, en un medio de cultivo
prácticamente cualquier célula con núcleo logra (después de un período
de desdiferenciación) iniciar el proceso de proliferación casi infinita
(a través de divisiones mitóticas), formando un callo que originará
nuevas plantas genéticamente iguales.
| |
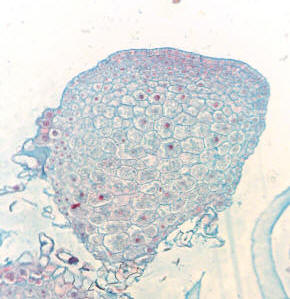 |
 |
|
|
Callo.
©
AMG |
Detalle donde las células
superficiales se están dividiendo para originar un vástago.
© AMG |
El procedimiento de cultivo de tejidos se inicia con la
toma de segmentos de plantas o explantos que se esterilizan y se
cultivan en soluciones nutritivas especiales, con frecuencia
gelificadas. A estos medios se incorporan combinaciones adecuadas de
hormonas de crecimiento para obtener una proliferación celular en el
segmento.
 |
 |
 |
|
Tubos con medio de cultivo
y cotiledones de algodón usados como explanto para la
multiplicación
© C.Luna. |
Micropropagación de arroz ©
M.A.Marassi. |
Frascos con
micropropagación de arroz in vitro por macollos ©
M.A.Marassi. |
La multiplicación del explanto puede originar:
 |
Organogénesis: formación de vástagos, raíces
y/o tallos que originen una o varias plantas nuevas completas. Este
proceso puede llevarse a cabo en varias etapas, modificando la
composición química del medio de cultivo y valiéndose de reguladores
de crecimiento.
|
 |
Embriogénesis somática: formación de
embriones somáticos (sin fecundación). |
|
Organogénesis |
 |
 |
 |
 |
| Regeneración
de vástagos de Guatambú in vitro
© C.Luna |
Enraizamiento
in vitro de Lapacho en medio
semisólido © C.Luna
|
Enraizamiento in vitro de
Lapacho en bioreactores de inmersión
temporal © C.Luna |
Enraizamiento
in vitro de Ilex paraguariensis en bioreactores de
inmersión temporal (note el sistema radical en estrella) ©
C.Luna |
La formación de nuevas estructuras puede ser directa:
a partir de células del explanto, o indirecta, formando primero
un callo o cúmulo de tejido poco diferenciado y amorfo,
constituido principalmente por parénquima fundamental.
| Regeneración directa |
Regeneración indirecta |
 |
 |
Formación de vástagos de
Grevillea robusta
directamente a partir de estacas
© C.Luna |
Formación de vástagos a
partir de un
callo
© M.A.Marassi |
| Semilla sintética: el resultado del
cultivo in vitro puede alojarse (encapsularse) en cápsulas gelificadas y
plantarse como "semillas artificiales o sintéticas".
Actualmente el concepto de semilla sintética ha sido ampliado,
consistiendo no sólo en la encapsulación de embriones somáticos,
sino también de meristemas caulinares, yemas axilares o
segmentos nodales, que pueden ser sembrados tanto en condiciones
in vitro como ex vitro (Aitken-Christie et al. 1995; Rai et al.
2009; Reddy et al. 2012). |
 |
|
semilla "artificial o
sintética" de mandioca,
©
Schaller 2016. |
El procedimiento de cultivo in vitro se aplica en
una gran variedad de plantas desde hierbas hasta árboles, especies
comestibles hasta ornamentales. El cultivo de tejidos y células
vegetales tiene otras aplicaciones tales como:
- propagación clonal.
- obtención de líneas de plantas genéticamente muy uniformes.
- almacenamiento o transporte de germoplasma vegetal
- producción a gran escala de plantas libres de agentes patógenos (ej.
bacterias, virus).
- participa de los procesos de transgénesis.
Apomixis o Agamospermia
Es una forma de multiplicación asexual con la formación
de semillas con un embrión genéticamente idéntico a la planta materna,
que se formó sin las etapas normales de la reproducción sexual:
 |
NO reducen a la mitad el contenido de cromosomas
durante la formación de las células reproductivas (gametas),
|
 |
NO hay fecundación |
 |
Se desarrolla un embrión GENÉTICAMENTE IDÉNTICO a la
planta madre. |
Los embriones se originan a partir de células del óvulo,
o sea maternas. Se forma una semilla verdadera y perfecta, que contiene
adentro un individuo idéntico a la planta materna. A veces la
fecundación es necesaria para formar el endosperma, pero otras veces
éste se desarrolla en forma autónoma.
Este modo de reproducción aparece naturalmente en muchas especies de
plantas como las frutillas, la manzana, los cítricos, el mango, la
mandioca y numerosas gramíneas forrajeras como el pasto horqueta (Paspalum
notatum) y el pasto llorón (Eragrostis curvula).
Existen dos tipos de apomixis:
 |
Esporofítica o embrionía adventicia: uno o
varios embriones se forman a partir de células no reducidas del
óvulo, como ser la nucela o tegumentos. Simultáneamente ocurre
meiosis que forma megásporas reducidas y un saco embrionario normal,
que por fecundación forma un embrión. La semilla resultante puede
tener entonces varios embriones (uno sexual y varios apomícticos
genéticamente iguales a la madre). |
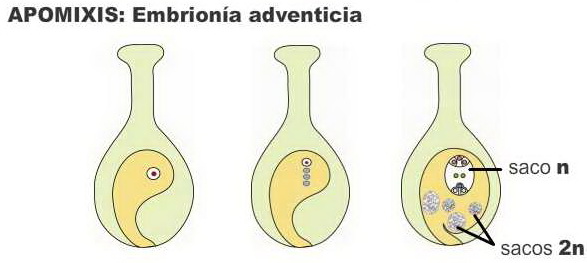
Imagen modificada de Hartmann and Kester’s Plant
Propagation, Principles and Practices 8 th ed.
 |
Gametofítica: la meiosis se altera o no
ocurre, en consecuencia el saco embrionario tiene sus células con la
dotación completa de cromosomas (2n) . No hay fecundación y la
ovocélula forma directamente el cigoto y luego embrión (por
partenogénesis), lo que mantiene las características maternas en su
totalidad. La formación de este saco puede tener dos orígenes:
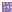 |
Diplosporia: la célula madre de la megáspora no
sufre meiosis o no la completa, formando un saco embrionario
tipo Polygonum de células no reducidas (2n). Es común en pastos
y Asteraceae. |
 |
Aposporia: células de la nucela forman
directamente (por mitosis) uno o varios sacos embrionarios (2n).
|
|
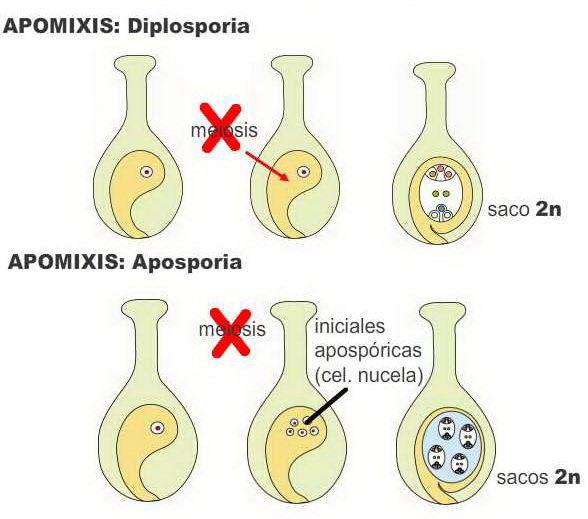
Imágenes modificadas de Hartmann and Kester’s Plant Propagation,
Principles and Practices 8 th ed.
Bibliografía
 |
Aitken-Christie, J., T.
Kozai & M. Smith. 1995. Glossary. En: Aitken-Christie, J., T. Kozai
& M. Smith (Eds.). Automation and Environmental Control in Plant
Tissue Culture, ix-xii p. Kluwer Academic Publishers, Dordrecht. The
Neetherlands. |
 |
Biotecnología y
Mejoramiento Vegetal II. Editores: V. Echenique, C. Rubinstein, E.
Hopp y L. Mroginski.
http://intainforma.inta.gov.ar/wp-content/uploads/2010/09/bio_WEB.pdf
|
 |
Campana, R.M.B.;
Ochoa,J.M. en Sozzi 2007; Propagación vegetativa o agámica de
especies frutales. Capítulo 5 (pp.135-197). |
 |
Carneiro V.T.C. , D.M.A.
Dusi, J.P.A. Ortiz. 2006 Apomixis:
Occurrence, Applications and Improvements Floriculture, Ornamental
and Plant Biotechnology Volume I. |
 |
Caracoche, C , Ing. Agr
Morelli, G.UNLP.
http://aulavirtual.agro.unlp.edu.ar/file.php/23/CURSADA/TP-S3-Guia_injertos.pdf |
 |
Fogliata, F. 1995.
Agronomía de la caña de azúcar. Tecnología. Costos. Producción. Tomo
I. Ediciones El Graduado, Tucumán, Argentina. 1451 págs. |
 |
Font Quer, P. 1993.
Diccionario de Botánica. Ed. Labor. Barcelona. |
 |
Hartmann, Hudson T.
1987. Propagación de plantas: principios y prácticas. México: Compañía
Editorial Continental, 760 p. |
 |
León,
J. 1987. Botánica de los cultivos tropicales. 445p. San José, Costa
Rica. IICA |
 |
Lima,
J., A. Lima, A. Bolfarini, S. Modenese-Gorla Da Silva. 2011.
Enraizamento de estacas de Camellia sinensis L. em função da época
de coleta de ramos, genótipos e ácido indolbutírico. Ciência
Rural 41: 230-235. |
 |
Mainardi Fazio, Fausta.
Manual práctico del horticultor moderno. Barcelona: De Vecchi, 1992.
222 p.: il. byn. (Colección Agricultura y Horticultura). |
 |
Marzocca, A.1993. Manual de
malezas. 4a ed. 684 p. Buenos Aires: Hemisferio Sur. |
 |
Mejía de Tafur, M. S.
2002. Fisiología de la Yuca (Manihot esculenta Crantz). La yuca en
el tercer milenio: sistemas modernos de producción, procesamiento,
utilización y comercialización. CIAT, Cali, Colombia. pp. 34–45. |
 |
Pessino S.; J.P. Ortiz;
V. Echenique, A.M. González; G. Seijo; C. Quarín. 2008. Apomixis: una
herramienta poderosa para el mejoramiento. Agromensajes 26, Facultad
de Ciencias Agrarias UNR.
http://www.fcagr.unr.edu.ar/Extension/Agromensajes/26/2AM26.htm |
 |
Rai, M., P. Asthana, S.
Singh, V. Jaiswal & U. Jaiswal. 2009. The encapsulation technology
in fruit plants-A review. Biotechnol. Adv. 27(6): 671-679. |
 |
Reddy, M. C., K. S. R.
Murthy, & T. Pullaiah. 2012. Synthetic seeds: A review in
agriculture and forestry. Afr. J. Biotechnol. 11(78): 14254-14275. |
 |
Roca, William M. Cultivo
de tejidos en la agricultura: fundamentos y aplicaciones. Cali:
Centro Internacional de Agricultura Tropical, 1991. 969 p. ISBN:
958-9183- 15-8. |
 |
Salas, Sanjúan. 2004. El
cultivo de la caña de azúcar en la costa granadina. Universidad
Almería, España. 109 p. |
 |
Schaller, Silvia
Cristina. 2016. Factores que afectan la propagación in vitro de
plantas de mandioca (Manihot esculenta Crantz] a partir de semillas
sintéticas. Trabajo Final de Graduación, Lic. Ciencias Biológicas,
Facultad de Ciencias Exactas y Naturales y Agrimensura-UNNE. |
 |
Sessa, C. 2013. Análisis
de Diagnóstico Tecnológico Sectorial Yerbatero y Tealero. Ministro
de Ciencia, Tecnología e Innovación Productiva, Argentina. 76 págs. |
 |
Sorghum halepense. L.
Pers. (sorgo de alepo): base de conocimientos para su manejo en
sistemas de producción Ing. Agr. E. Leguizamón. 2006.
http://www.produccion-animal.com.ar/produccion_y_manejo_pasturas/pasturas_combate_de_plagas_y_malezas/94-sorghum_halepense.pdf
|
 |
Sozzi, G. O., 2007.
Árboles frutales: ecofisiología cultivo y aprovechamiento.Gabriel
Oscar Sozzi. (Ed.) Buenos Aires: Editorial Facultad de Agronomía.
Universidad de Buenos Aires, 805 pp. |
 |
Suárez Guerra, L., V. Mederos Vega. 2011. Apunte sobre el cultivo de la yuca (Manihot
esculenta Crantz) tendencias actuales. Cultivos Tropicales. 32 (3):
27-35. |
 |
Vila S., A.M. Gonzalez,
H. Rey & L. Mroginski. 2009. Somatic embryogenesis and plant
regeneration in Cedrela fissilis. Biologia Plantarum 53 (2):
383-386. |
 |
CUADERNOS DE
BIOTECNOLOGÍA |
COLABORADORES: esta página tuvo la
valiosísima contribución de docentes e investigadores las
siguientes cátedras de Facultad de Ciencias Agrarias, UNNE (Corrientes)
que además de facilitarnos muchas imágenes (propias o de productores
locales) contribuyeron con su conocimientos sobre los cultivos locales.
 |
Silvicultura y Lab. Biotecnología aplicada y
genómica funcional, Prof. Claudia Luna, Gabriela Ayala y
colaboradores. |
 |
Cultivos III, Profs. Angela Burgos, Ricardo Medina y
Pamela Dirchwolf. |
 |
Fruticultura, Prof. Paula Alayón Luaces. |
 |
Fisiología Vegetal, Prof. María Antonia Marassi. |
 |
Terapéutica, Prof. José Tarragó |
ENLACES
|
|
